Tabela de conteúdos
Introdução ao Vidro e sua Produção
Estrutura do Vidro
Mas o que é o vidro? Para responder a esta pergunta vamos recordar alguns conceitos que todos já vimos na escola.
Toda substância é constituída de átomos. Eles são muito pequenos e impossíveis de se ver, mesmo com os mais poderosos microscópios, e todas as características e propriedades dos materiais dependem de como estes átomos se ligam entre si.
Um exemplo que mostra claramente isto são três materiais: o carvão, o grafite e o diamante, que são constituídos do mesmo elemento químico, o carbono, cujos átomos em cada um deles se encontram unidos por diferentes tipos de ligação. Como resultado, estes três materiais têm comportamento e aspecto totalmente distintos.
Outro conhecimento básico são os três estados em que as substâncias podem se encontrar: sólido; líquido e gasoso. Cada substância tem uma temperatura característica de fusão e evaporação. Abaixo da temperatura de fusão, será sempre sólida. Entre a temperatura de fusão e de evaporação, será líquida, e acima da temperatura de evaporação, passará a ser um gás.
Um exemplo clássico é a água: abaixo de 0oC ela é sólida (gelo), entre 0oC e 100oC está líquida e acima de 100oC se transforma em vapor, que é um gás.
Quando a substância está no estado sólido há uma grande força de atração entre os átomos que ficam presos uns aos outros, e esta força faz com que eles de disponham de forma organizada, como soldados numa parada militar.
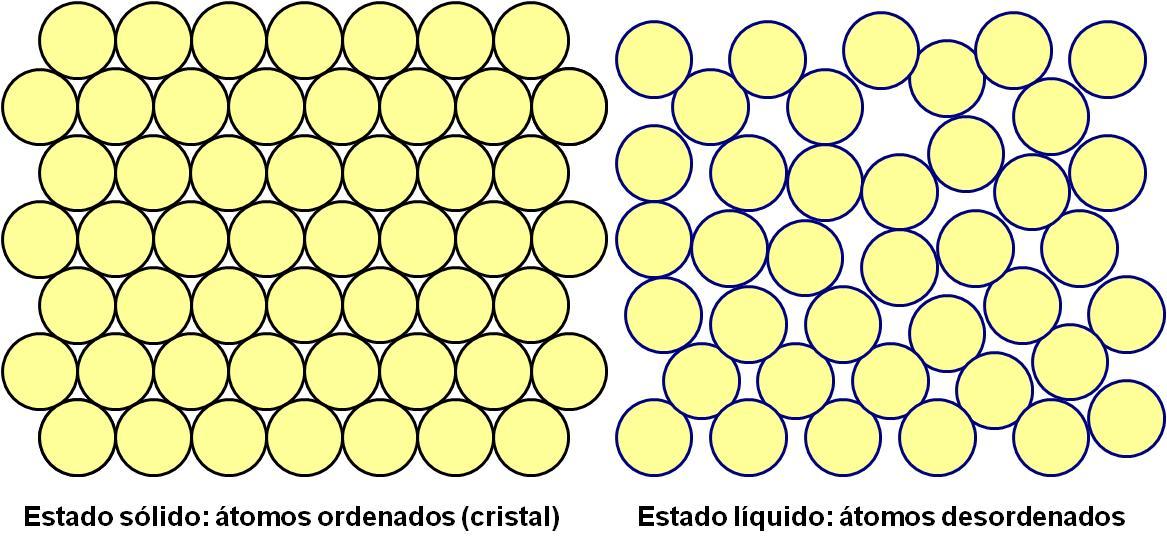
No estado líquido a força que os une é muito fraca e os átomos ficam soltos e o material pode fluir. Imagine uma lata cheia de bolinhas de gude e que cada bolinha seja um átomo. Quando o material está no estado líquido, as bolinhas, ao serem jogadas ao chão, correm soltas e se espalham, assim como ocorre quando jogamos a água. As bolinhas soltas rolam umas sobre as outras sem organização. No estado sólido é como se colássemos cada bolinha com a sua vizinha, formando um arranjo ordenado que se repete ao longo de todo o material. Este arranjo de átomos organizados é denominado “cristal” e, portanto, um sólido cristalino é aquele em que seus átomos estão dispostos de forma organizada. A Figura 15 esquematiza o arranjo atômico nesses dois estados
Figura 15: Arranjos atômicos no estado sólido e líquido
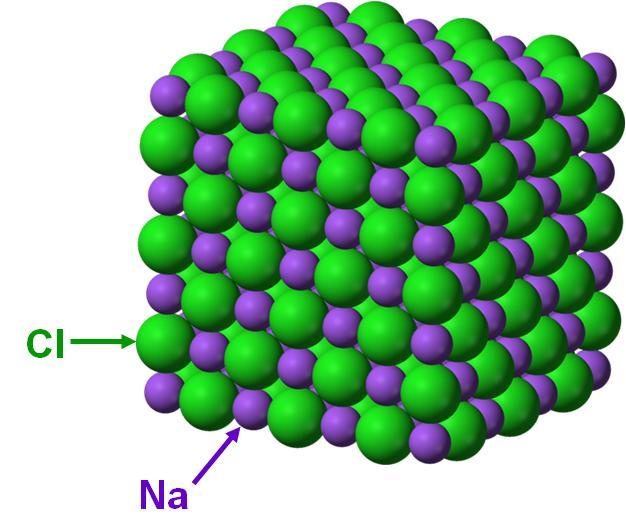
Um exemplo de sólido cristalino é o cloreto de sódio, o sal que empregamos para temperar alimentos. Ele é constituído de dois elementos: o sódio e o cloro que, quando no estado sólido, apresentam a estrutura representada na figura 16.
Figura 16: Arranjo cristalino dos átomos no sal de cozinha.
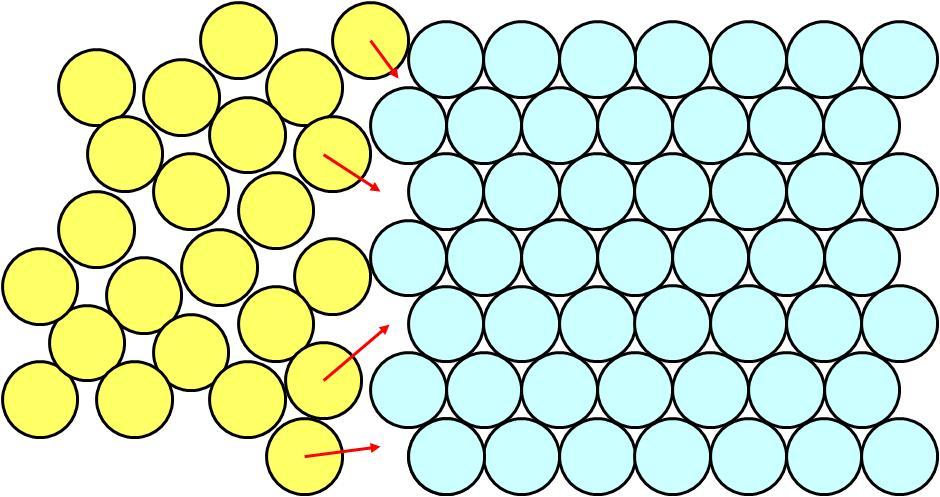
Portanto, quando se esfria um material abaixo de seu ponto de fusão, os átomos que antes estavam desorganizados devem se movimentar entre si para poderem ocupar os lugares determinados por uma situação de organização.
Esta movimentação esta representada na figura 17.
Figura 17: Movimentação dos átomos na passagem do estado líquido para o sólido
Um material que gera o vidro em alta temperatura também se torna um líquido, porém apresenta alta viscosidade. A viscosidade é a dificuldade de os átomos se moverem uns em relação aos outros e, quanto maior ela for, mais dificuldade tem o líquido de escoar. Um exemplo de líquido viscoso é o mel. Se jogarmos água e mel sobre uma superfície plana, a água que apresenta baixa viscosidade vai escorrer com facilidade, mas o mel que é muito viscoso vai escoar bem devagar e também não vai conseguir se espalhar como a água.
Um material fundido que vai gerar vidro é viscoso e se comporta como o mel e, à medida em que se esfria, sua viscosidade aumenta cada vez mais, dificultando ainda mais a movimentação livre dos átomos que não conseguem se organizar como no estado sólido de outros materiais.
Chega um momento, em uma determinada temperatura, que a viscosidade é tão alta que os átomos não conseguem mais se movimentar de forma alguma e a estrutura de líquido com os átomos desorganizados, fica congelada em um material com todas as características de um sólido.
Todas as características e propriedades do vidro devem-se a esta estrutura desordenada de suas moléculas.
Dessa forma,muitas vezes o vidro é chamado de líquido. Porém isso não é verdade. O vidro é um sólido que apresenta a estrutura semelhante à de um líquido, isto é, seus átomos não estão organizados na forma de cristais como acontece com a maioria de substâncias sólidas que conhecemos.
Estrutura do vidro e Processo produtivo
Uma consequência da estrutura desordenada do vidro é que uma mesma massa deste material ocupa um volume maior do que se seus átomos estivessem na forma cristalina.
E na prática, quando produzimos o vidro a partir do esfriamento de um líquido viscoso, dependendo da velocidade em que se dá o resfriamento, pode-se ter uma pequena organização.
Falando de outra maneira, quanto mais rápido se esfria, maior é a desordenação dos átomos e, portanto, maior o volume ocupado.
Podemos fazer um paralelo quando saímos para viajar de férias. Ao preparar a mala, escolhemos com cuidado todas as roupas que pretendemos levar, estão no armário, bem passadas e dobradas e as colocamos com cuidado na mala. Desta maneira a mala fecha sem dificuldade.
No retorno das férias, as roupas já foram todas usadas, foram deixadas em algum lugar sem o cuidado de serem dobradas e, como estamos tristes porque as férias acabaram, fazemos a mala rapidamente, sem paciência, apenas com a intenção de levar tudo de volta, afinal, terá mesmo de ser lavado.
Resultado: a mala da volta, mesmo contendo as mesmas roupas da ida, fica mais volumosa e eventualmente até difícil de fechar.
Com o vidro acontece algo semelhante: se ele é esfriado rapidamente seus átomos ficam mais “bagunçados” do que se ele for esfriado lentamente e, portanto, ocupa um volume maior.
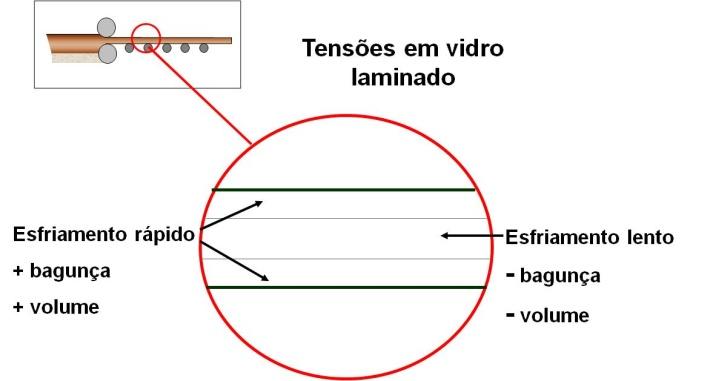
Quando fazemos a conformação de qualquer vidro, por exemplo, uma chapa sendo laminada entre dois rolos metálicos, partes deste vidro se esfriará mais rápido que outra, neste caso a pele em contato com os rolos, do que o vidro do centro da chapa que vai se esfriar mais lentamente e, portanto, seus átomos poderão ter uma maior organização que, no fina,l ocupará volume menor. Porém, tudo isso será uma chapa única, e estas diferenças de volumes gerarão tensões que podem quebrar o vidro, ou pelo menos fragilizá-lo. A Figura 18 mostra a evolução de tensões surgidas na laminação.
Figura 18: Desenvolvimento de tensões durante a laminação de uma chapa de vidro
Na produção de garrafas e outros artigos conformados em moldes metálicos, o mesmo fenômeno acontece exigindo que todo produto de vidro, após a sua conformação, sofra um processo de aliviamento de tensões denominado recozimento.
Portanto, após a conformação, sempre é necessário efetuar um recozimento do vidro, isto é, se aquece até a viscosidade diminuir e permitir a acomodação destas tensões, seguido de esfriamento lento, por igual em todo o corpo da peça, para evitar tensões residuais.