Essa é uma revisão anterior do documento!
Tabela de conteúdos
Elaboração do Vidro
Para se ter vidro, portanto, é necessário um material que quando fundido tenha uma alta viscosidade, e que esta viscosidade aumente muito antes de chegar ao ponto de solidificação, impedindo a ordenação dos átomos (que se chama cristalização).
Não são todos os materiais que se prestam para gerar vidros. A água, por exemplo, é uma delas, pois sua viscosidade é praticamente a mesma, e muito baixa, ente a sua temperatura de fusão (0oC) e sua temperatura de evaporação (100oC). Portanto não importa quão rápido se esfrie a água, sempre seus átomos poderão se movimentar entre si para gerar um cristal (átomos ordenados).
Porém várias substâncias não são assim. Por exemplo: o açúcar. Na temperatura ambiente ele é um cristal. Cada grão é um pequeno cristal. Se o aquecermos eles se fundem, tornam-se um líquido, formando o caramelo. Se jogarmos este caramelo na superfície fria da pia ele se solidifica sem se cristalizar, formando, portanto, um vidro. (Sim, bala de açúcar é um vidro!)
Aliás, vidro de açúcar é empregado no cinema para que nas cenas de quebra de vidraças não haja risco de acidente com os atores, porém não podemos instalá-lo em nossas janelas, pois com a chuva e lavagem eles desapareceriam dissolvidos na água.
A Figura 19 mostra a “fabricação” de vidro de açúcar
Figura 19: “Fabricação” de vidro de açúcar
O material mais empregado, e que gera vidro da mesma maneira que o açúcar, é a sílica ou óxido de silício (SiO2), muito abundante na natureza. Ela é nossa velha conhecida na forma da areia que há nas praias ou na areia empregadas nas construções. A Figura 20 mostra algumas formas de sílica encontradas na natureza.
Figura 20: Alguns materiais encontrados na natureza e constituídos de sílica.
Se pudéssemos observar os átomos de um grão de areia, veríamos que eles se organizam formando cristais, que são disposições organizadas e com formação repetitiva. Se fundirmos estes grãos a organização acaba; se esfriarmos rapidamente (e nem precisa ser muito rapidamente), os átomos não conseguem se reorganizar, permanecem amorfos (sem organização), gerando o vidro com propriedades e características muito boas para as nossas aplicações, diferentemente do vidro de açúcar.
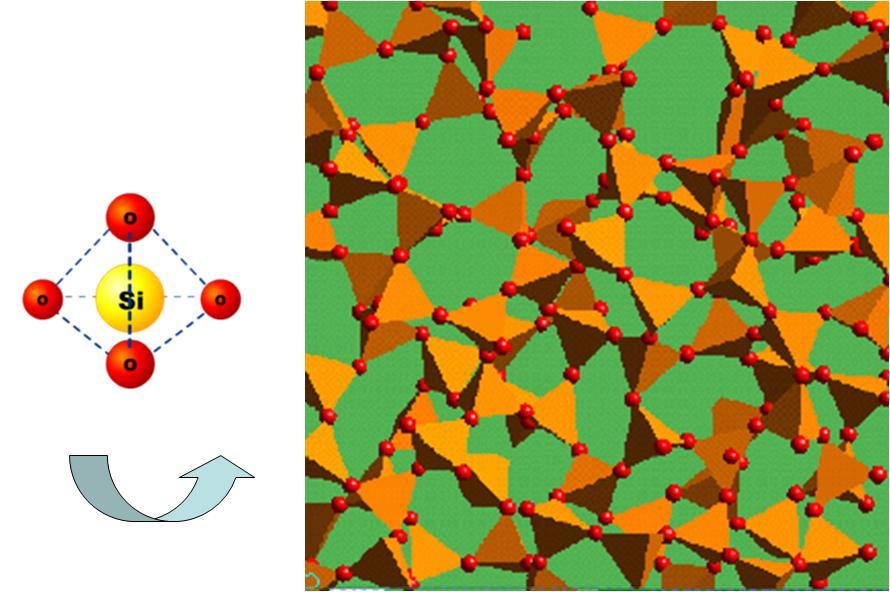
A Figura 21 mostra uma unidade estrutural da sílica que; constitui-se de um átomo de silício rodeado de quatro átomos de oxigênio, formando um tetraedro (figura de quatro faces sendo cada uma um triângulo) Esses átomos se unem pelos oxigênios formando uma rede tridimensional, que é a estrutura do vidro.
Figura 21: Unidade estrutural da sílica e como estas se unem formando uma rede espacial que é a estrutura básica do vidro.
Na figura 22 estão representadas a estrutura molecular de uma sílica cristalina, como é encontrada na natureza e a mesma estrutura quando transformada em vidro. Podemos fazer uma analogia onde cada molécula de sílica é um tijolo. Na forma cristalina, os tijolos estão ordenados como numa parede. No vidro, os mesmos tijolos, estão em desordem, como se tivessem sido jogados ao acaso em algum lugar.
Figura 22: comparativo entre a sílica na forma cristalina e na forma vítrea
Vidros industriais
A sílica sozinha produz um excelente vidro com ótimas propriedades, porém com um grave problema: seu ponto de fusão é muito alto, requerendo fornos especiais e muito consumo de energia e, consequentemente, apresenta alto custo de produção.
A solução encontrada para contornar este problema foi a de incorporar elementos fundentes à sílica, que baixam a temperatura de elaboração, mas mantêm características adequadas para os produtos. Estes fundentes são o óxido de sódio e o óxido de cálcio os quais, em conjunto com a sílica, produzem a família de vidro denominada silico-sodo-cálcico ou simplesmente sodo-cálcico.
Ação dos Fundentes
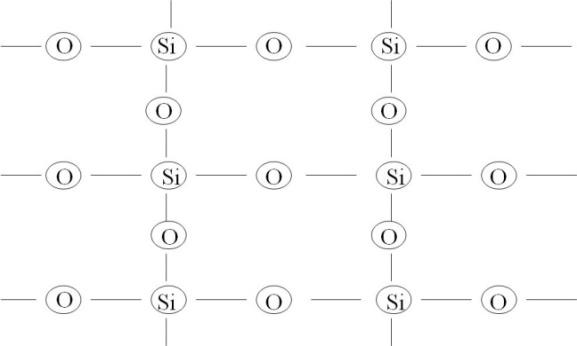
A estrutura básica dos vidros à base de sílica é uma rede formada de silícios ligados cada um a quatro oxigênios, e cada oxigênio liga dois átomos de sílica, como mostrado na Figura 23. Esta figura é apenas esquemática, pois está nos dois planos do papel, mas na realidade a rede da sílica é tridimensional. Estas ligações são muito fortes, razão do alto ponto de fusão dos cristais de sílica, e mesmo no estado líquido elas continuam a agir provocando a alta viscosidade.
Figura 23: Esquema das ligações dos átomos em um vidro de sílica
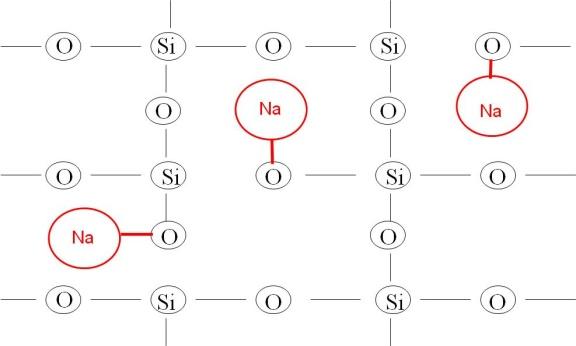
Quando se adiciona o sódio à sílica, os átomos de sódio que têm muita afinidade com o oxigênio unem-se a ele; e os oxigênios que se unem aos sódios, deixam de ficar ligados ao silício, fazendo desta maneira um corte na rede. Quanto mais sódios se adicionam, mais cortes na rede se apresentam e mais fraca ela fica. Isto na prática se traduz com viscosidade mais baixa e menor temperatura de elaboração do vidro. A Figura 24 mostra o efeito da introdução de sódio na estrutura do vidro de sílica.
Figura 24: Representação esquemática do efeito da adição de sódio ao vidro de sílica.
A introdução de sódio ao vidro traz um novo problema. Ele aumenta a solubilidade do vidro, isto é, quanto mais sódio se adiciona, mais o vidro fica próximo ao vidro feito de açúcar, conforme já citado,
Por essa razão, introduz-se o sódio até determinado limite, e como neste limite o vidro ainda se encontra muito viscoso para ser elaborado e trabalhado em temperaturas industrialmente razoáveis, introduz-se um segundo fundente, que é o cálcio.
O cálcio como o sódio se une aos oxigênios liberando ligações entre este e a sílica, mas como ele é bivalente, cada átomo de cálcio se une a dois átomos de sódio.
Por ele gerar uma nova ligação para cada duas destruídas, ele não é tão eficiente como o sódio,;porém por ser muito pouco solúvel em água, pouco afeta a resistência do vidro à solubilidade.
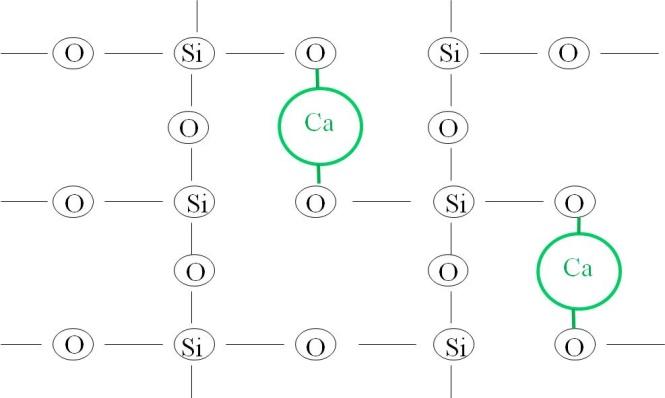
O efeito da introdução do cálcio ao vidro esta esquematizado na figura 25.
Figura 25:Representação esquemática do efeito da adição de cálcio ao vidro de sílica.
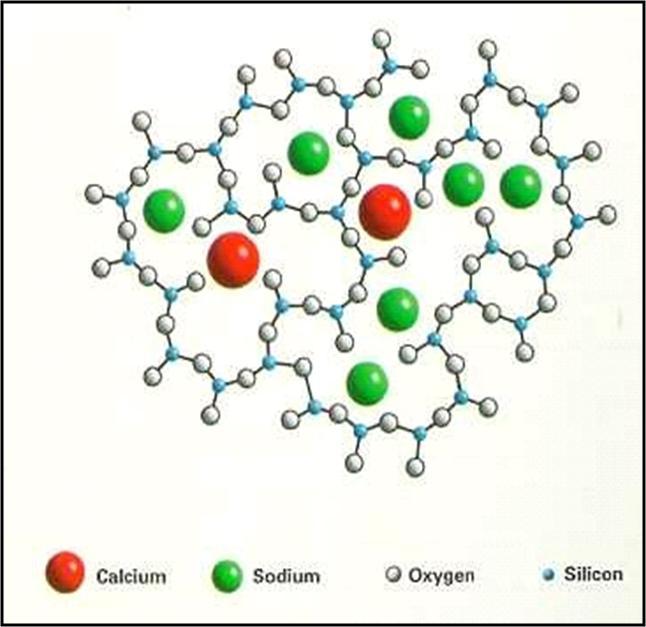
A estrutura de um vidro sodo-cálcico pode ser representada pela figura 26 que mostra a rede de sílica interrompida pela presença de átomos de sódio e cálcio.
Observar que como o vidro não apresenta estrutura ordenada cristalina, por exemplo, a do sal de cozinha da Figura 16, pode receber diferentes quantidades de cada um dos fundentes, assim como de diversas outras substâncias e, portanto apresentar um leque infinito de propriedades
Figura 26: Esquema da estrutura molecular de um vidro sodo-cálcico
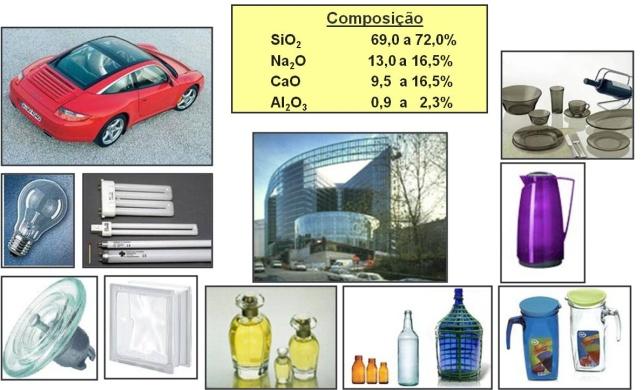
Vidros sodo-cálcicos são empregados para a maioria das embalagens, vidraças, lâmpadas, artigos domésticos, entre outros, participando com mais de 90% de todo o vidro produzido no planeta.
A Figura 27 mostra exemplos de aplicações de vidros sodo-cálcicos e a faixa de composição química em que eles se situam.
Figura 27: Exemplos de produtos produzidos a partir do vidro sodo-cálcico e faixa de composição química em que eles se encontram.